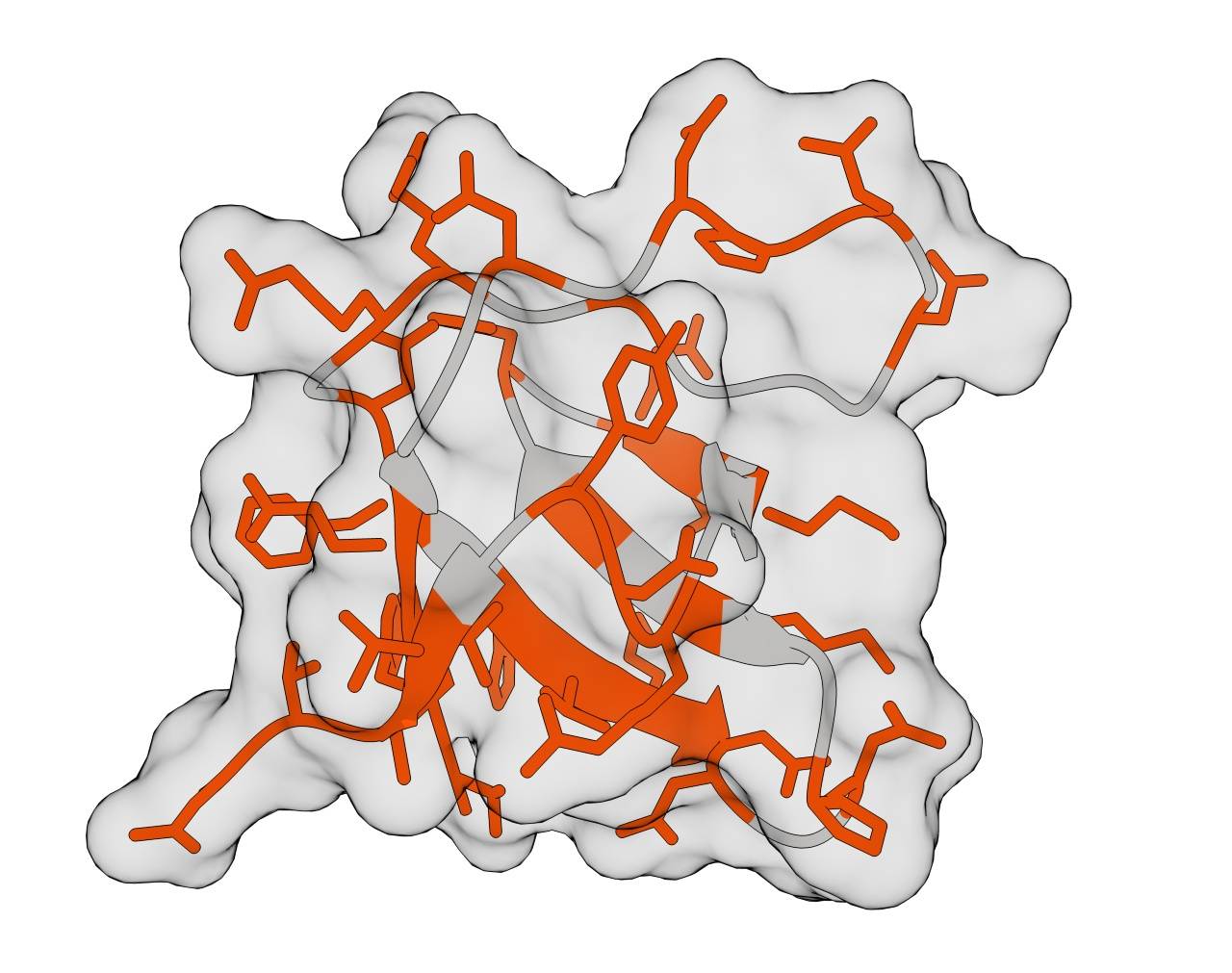
Un equipo del Centro de Regulación Genómica (CRG) y el Wellcome Sanger Institute (Reino Unido) ha descubierto que las mutaciones afectan a la estabilidad de las proteínas siguiendo reglas muy sencillas.
El hallazgo, publicado hoy en la revista Nature, tiene profundas implicaciones para acelerar el desarrollo de nuevos tratamientos para enfermedades o el diseño de nuevas proteínas con aplicaciones industriales.
El hallazgo puede acelerar el desarrollo de nuevos tratamientos para enfermedades o el diseño de nuevas proteínas con aplicaciones industriales
Las proteínas son cadenas formadas por veinte tipos diferentes de aminoácidos. Una sola mutación cambia un aminoácido por otro, y esto modifica la forma de la proteína, lo que puede marcar la diferencia entre la salud y la enfermedad.
Predecir cómo las mutaciones alteran la forma de una proteína es fundamental para comprender su contribución a patologías como el cáncer. Sin embargo, con tantos aminoácidos en una proteína, hay un número astronómico de combinaciones de mutaciones. Es más, probar cada combinación posible para ver cómo afectan a una proteína es prácticamente imposible.
“Permitiendo solo un cambio en cada posición, hay 17.000 millones de combinaciones diferentes en una proteína de 34 aminoácidos de longitud. Si tuviéramos un segundo para probar una sola combinación, tardaríamos un total de 539 años para probarlas todas. No es un experimento factible”, afirma Aina Martí Aranda, coautora del estudio, que inició el proyecto en el CRG y actualmente está en el Wellcome Sanger.
Impacto en la estabilidad de las proteínas
A medida que las proteínas se hacen más largas, el número de combinaciones aumenta exponencialmente. Para una de 100 aminoácidos de largo, hay más combinaciones posibles que átomos en todo el universo. Y la gran mayoría de ellas, especialmente las que contribuyen a las enfermedades humanas, son mucho más largas.
Incluso en este vasto panorama de posibilidades, la investigación ha descubierto que el impacto de las mutaciones en la estabilidad de las proteínas es más predecible de lo que se pensaba.
Predecir cómo las mutaciones alteran la forma de una proteína es fundamental para comprender su contribución a patologías como el cáncer
Durante años, ha existido la idea de que dos mutaciones podrían interactuar entre sí de maneras inesperadas, aumentando o suprimiendo los efectos de la otra. “El miedo a que la interacción de dos mutaciones pueda afectar de forma impredecible a toda la estructura nos hizo utilizar modelos increíblemente complejos”, explica Martí Aranda.
El estudio reveló que, si bien las mutaciones interactúan, es un hecho relativamente raro, y la gran mayoría afectan a la proteína de forma independiente.
Unas reglas sencillas
“Nuestro descubrimiento muestra que las infinitas posibilidades de las mutaciones de las proteínas se reducen a reglas sencillas. No necesitamos supercomputadoras para predecir el comportamiento de una proteína, solo buenas mediciones, y las matemáticas simples hacen el resto”, explica Ben Lehner, que trabaja en los dos centros.
El equipo hizo el descubrimiento generando miles de variantes de proteínas, cada una con diferentes combinaciones de mutaciones que podrían producir proteínas funcionales. A continuación, probaron su estabilidad. Los resultados experimentales coincidieron con modelos que asumen que el efecto total de múltiples mutaciones se puede calcular simplemente sumando los efectos de cada mutación individual.
No necesitamos supercomputadoras para predecir el comportamiento de una proteína, solo buenas mediciones, y las matemáticas simples hacen el resto
Ben Lehner (CRG)
Comprender mejor las enfermedades
Los hallazgos ayudan a comprender mejor y abordar las enfermedades genéticas. Por ejemplo, algunos trastornos genéticos son causados por muchas mutaciones en una proteína. Los pacientes pueden tener diferentes combinaciones de mutaciones, lo que constituye un desafío para predecir la gravedad de la enfermedad y la respuesta a los tratamientos.
Con la nueva conclusión de que la mayoría de las mutaciones actúan de forma independiente, se pueden encontrar nuevas formas de predecir cómo las diversas combinaciones de mutaciones afectan a la estabilidad y a la función de una proteína. Esto puede llevar a pronósticos más precisos y planes de tratamiento personalizados, mejorando los resultados de los pacientes, según los autores.
Desarrollo más eficiente de fármacos
Aunque los hallazgos pueden reducir drásticamente el número de experimentos necesarios, aún será necesario cierto nivel de validación experimental para confirmar las predicciones
El estudio también puede llevar a un desarrollo de fármacos más eficiente. Algunos fármacos corrigen las proteínas mal plegadas, como en la enfermedad de Alzheimer, donde la forma cambiante de las proteínas betaamiloides forman placas en el cerebro. Ahora se podría predecir mejor qué mutaciones son más desestabilizadoras y diseñar moléculas que estabilicen estas regiones.
El estudio también tiene implicaciones para los biotecnólogos que utilizan el diseño de proteínas para abordar diferentes retos, dicen los autores. Por ejemplo, algunas enzimas tienen la capacidad de descomponer los plásticos en el medio ambiente. Se podrían diseñar nuevas enzimas con mayor actividad y estabilidad mediante la adición de mutaciones beneficiosas.
Limitaciones del trabajo
Si bien el estudio supone un avance significativo, no se capturaron interacciones más complejas que involucraban tres o más mutaciones. En algunas proteínas, estas interacciones de orden superior podrían afectar significativamente a la estabilidad y no se predicen simplemente sumando los efectos individuales.
Además, aunque los hallazgos pueden reducir drásticamente el número de experimentos necesarios, aún será necesario cierto nivel de validación experimental para confirmar las predicciones, especialmente para aplicaciones críticas como el desarrollo de medicamentos, donde puede haber efectos imprevistos o interacciones raras que los modelos no capturan.
Referencia:
Faure et al.: ‘The genetic architecture of protein stability’. Nature (2024).
Fuente de esta noticia: https://www.agenciasinc.es/esl/Noticias/Simples-calculos-matematicos-pueden-predecir-la-estabilidad-de-las-proteinas
También estamos en Telegram como @prensamercosur, únete aquí: https://t.me/prensamercosur Mercosur
Recibe información al instante en tu celular. Únete al Canal del Diario Prensa Mercosur en WhatsApp a través del siguiente link: https://www.whatsapp.com/channel/0029VaNRx00ATRSnVrqEHu1W
- Campañas de la Comisión Administradora del Río de la Plata para la gestión de recursos ictícolas - 26 de septiembre de 2024
- Emergencia energética: ¿cuáles son las medidas que prepara el Gobierno de cara al verano? - 26 de septiembre de 2024
- El dragado del antepuerto de Montevideo comenzará en los próximos días - 26 de septiembre de 2024
